無法取得影片資訊
2023-09-08
溫溫
1.6k
✅如何建立完整機制提升醫材產品品質 ✅如何遊任ISO13485 一鍵搞定DHR ✅如何深根醫材市場做到穩定成長 ✅更多醫材產業知識→ https://pse.is/BlackJack_DGW_go
在前集的介紹中,我們知道導入ISO 13485對醫材企業帶來的好處,也知道準備DMR/DHF/DHR,所面臨的大量工作處理的困難。醫材製造商作為專業廠商,需"證明"自己有能力提供能「滿足客戶需求」又同時「符合法規要求」的醫療器材產品。DHR就是生產/製造歷程紀錄,可用以佐證製造商所生產的產品,是能符合經批准的DMR的(醫療器材主紀錄)。
面對未來逐步提高標準的管理及要求,我們今天就來搭配法規要求與實務狀況作業,來了解醫材企業在推動DHR的過程,會有那些實務上的問題及挑戰!
台灣的醫療相關領域的實力國際知名。近年國內的醫療器材管理法也已與國際標準接軌,所以對於醫療器材製造業者的要求,也越來越嚴格。像是製造廠的場所設施、設備、組織與人事、生產、品質管制、儲存、運銷、客戶申訴及其他事項之規範,都要參照ISO13485的規範內容來記錄訂定。(第2條)在ISO13485法規上,說明DHR的內容須包含:
(a)製造日期;
(b)製造數量;
(c)放行銷售數量;
(d)證明器材之製造符合DMR規定之驗收測試記錄;
(e)用於各生產單位(或批)的重要識別標籤與標示;
(f)所使用的器材識別號碼和管制號碼。
這樣看起來,似乎不難,但執行起來卻不是如此。ISO13485上面還是用這樣的方式分類,主要原因是每個產品的DMR都不同,自然DHR的紀錄內容也會有不同的測重點。我們先來看個簡單的例子。這是一本外科手術的歷史書,中文翻譯成《手术刀帝国:外科史》。
(圖片來源:https://www.eslite.com/product/1001294886391469)
這本書的封面都是「手術刀」,但顯而易見,隨著科技進步的發展,手術刀的精細程度也會有所變化。每種規格的手術刀,也會有不同的目的,這也是研發在做的事情,就是產品的「改良」。醫材也是會經過一次次的改良,讓人在使用上變得更方便、更符合人體工學。而產品有不同的目的,那麼DMR就會不同,自然地,DHR的紀錄內容就會不同了!這就是為什麼DHR會那麼頭痛的地方,因世代進步,產品會日新月異,產品的變化會左右DHR的內容要記錄哪些。而這也是為什麼ISO13485要求的DHR內容範疇僅以這6類來表示。
但講到這裡,想必也會有(像溫溫一樣的)人覺得:「這樣的改良,在製程上的紀錄,頂多是大小不同、角度不同…其他要紀錄的內容,應該也不會變化太多吧?」
確實,相對來說手術刀講求的是複雜且細緻的工藝能力。我們再來看另一個例子 —— 如台科大的設計師團隊就改良的點滴架的結構,讓重心更加穩定、握把處加入人體工學、行走更加方便,還加入點滴袋的餘輛提醒。
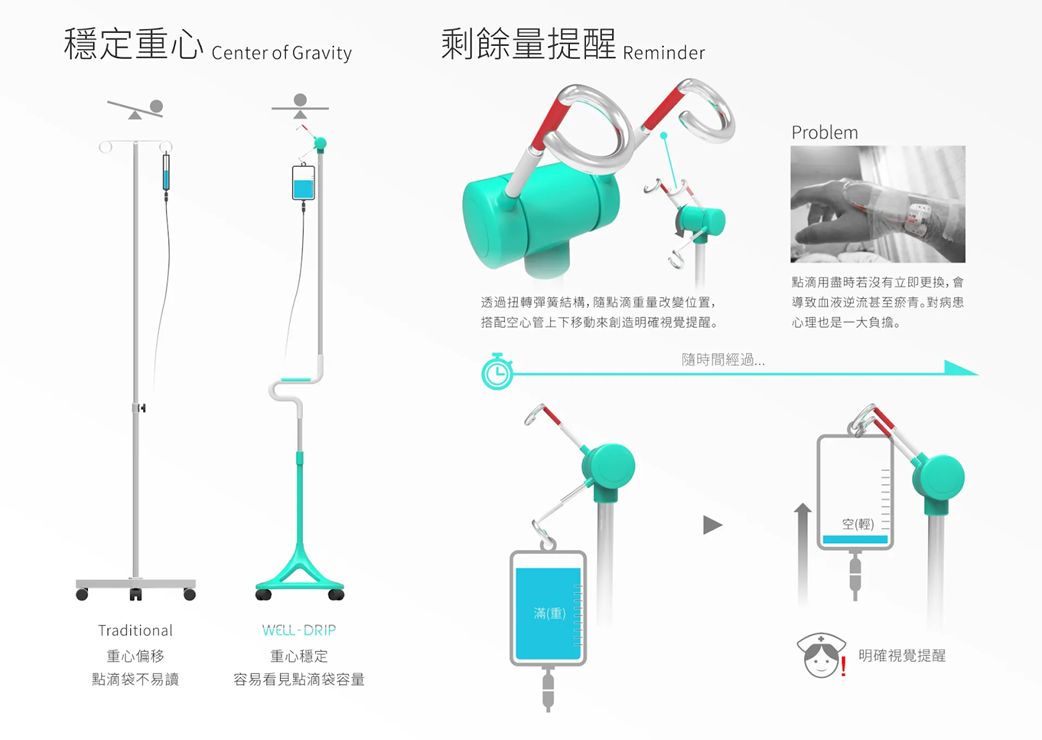
(圖片來源:https://www.taipeidaward.taipei/Post/91574)
現在的產品要兼顧美觀、功能,如果要量產這樣的產品,製造單位一定要做好追蹤記錄,確保每個環節的設計功能都能正常運作。若用DHR文件的角度來看,原本的點滴架只有金屬、塑膠輪,頂多再加上調整高度的塑膠栓,但現在這項新的點滴架設計,就包含了把手的橡膠、餘量提醒的彈簧結構。我們單單來看用料的部分就好,現在增加了兩種用料而已,在採購、領料、生產作業、減菌紀綠、品質檢驗…就會再多一堆數據要記錄了…
醫材企業各有專精,初期生產的品項少文件還容易快速對焦。但隨著公司的成長組織分工,生產的品項愈來愈多,用料愈複雜,生產的製程愈專業,要記錄的也會增加。如增減及調整作業站,增加用料率,增加生產紀錄內容等。因為隨著產品、製程及材料的增加,彙整的工作量確實會成指數性成長。不同產品DMR有不同的記錄要求,加上製程的多樣性,光是將相關數據彙整就要花很多時間。
剛剛講的這些是「產品少量多樣與持續創新」,對於DHR歷史資料的影響。除了這以外,資料還必須要「彙整」,才能成為完整的DHR。但要「彙整成完整的DHR報告」,還是得有個前提,就是「正確性」。
講到這裡就要再提一下,你剛剛提到的,需練就考古能力的QA們。
大多醫材廠在每次內部檢核時,通常都會由QA作為PM的角色進行彙整,透過手工方式將廠內製令單、生產領料單、生產作業單、減菌紀綠單及各式品檢作業報告整理。
(DHR涉及不同部門 (管理/生產/倉管/品保)、不同職能與作業 (採購/領料/生產/委外/品檢/出貨)這部分,相信大家一定都很清楚了!)
如果說DHR以人工方式填寫,一但手寫的資料有問題,往往要在彙整後才能發現。
(並不是說人工不好,但只要是人工,就會有資料正確性的風險在。)
QA發現後要找生產及管理部門主管確認,如果確認已寫的問題,要再去找其他的生產紀錄是否有同樣的問題。於是QA又要再用一樣的方式再彙整紀錄報告,找人員確認。
那如果後來又在發現一次資料比對不起來,或有填寫錯誤,就得要再重來一次。就像RPG遊戲一樣,就好像跌到鱷魚坑,然後要回到初始點重新再走過一樣的路、和一樣的角色說話(生產及管理部門主管)…
但有一點不一樣。因為除了日常內檢及外檢的活動,不時還會要支援各式查驗處理。如果遇到客戶或三方機構來廠查驗時才發現問題,往往都要動員各部人員緊急動員處理。相信大家都知道的,DHR的紀錄內容存在不確實問題的話,輕微的小問題,會是客戶不放心將更多單交給你,間接制約營收成長;但若是嚴重的問題(或連續不合要求),客戶是會決定轉單其他廠商。
那說了半天,今天要講的「遊刃ISO13485」到底要怎麼做呢?
讓”DHR能控、能管”的關鍵就在於藉由系統化及數位化控制過程。
讓生產紀錄與系統工作確實結合,相關人員工作全面透過系統化記錄。讓紀錄可追溯、能快速追溯。對內/外稽核時,能快速回應、確認問題、找問題原因,甚至能快速找出其他潛在有問題批號。
DHR的管控機制推動過程有以下兩個重點:
1.在關鍵製程設置卡控機制/減少生產資料的人工填寫
依DMR的要求設計,逐步提升DHR資料輸入系統化的能力。意思是指,DMR在一開始都已經被批准了,那麼在生產過程中要紀錄的內容,其實生管人員都一定會看過DMR,在投產前也都會知道。所以在開始生產前,要記錄甚麼樣的資料,就可以提前以系統性思維做規劃,展開要紀錄的規劃了。雖然生產過程當中,會有甚麼樣的變化我們沒辦法預知,但其實生管可以透過DMR知道現在這些準備要投產的製程,會和過去的產品有那裡不一樣,就能夠留意甚麼該紀錄、甚麼該留意,甚至是透過DMR找到關鍵製程,然後在關鍵製程設置卡控機制。
2.依照稽核場警/提前設計彙整資訊/減少歷程報告的人工彙整
依稽/外查驗的場景設計,提前準備DHR數據彙整及查驗的能力。「依場景設計」是指~DMR再一開始都已經被批准了,所以再稽核查廠時,大致上都可以知道要提出甚麼樣的DHR文件,對吧?所以「彙整」這件事情,其實也可以提早準備,甚至是在開始生產前就可以想像出來的。
再來就是這兩項都有提到的「減少人工」,因為人都是有極限的。減少人工除了省時省力(不虐待QA)以外,也是更確保資料的完整與正確性。
第一點的【1.減少生產資料的人工填寫】撇除所有製造業都會遇到的「筆跡潦草」問題,對於報工人員來說,紙本記錄是最快的,沒有框架、沒有格式限制,如果說寫錯格也沒有卡控機制,是不是整份資料就會出現錯誤呢?重點是,在當下還不會知道有問題喔!所以就會延伸到第二點的【2.減少歷程報告的人工彙整】,如果QA查驗人員在後續才發現資料比對不起來,就得花時間去問、去找、去追、去考古。那就算資料都正確了,還是需要QA們花時間來整理報表資料。
過往要一週的DHR文件彙整的工作,現在一小時內就可以完成整合的準備工作。在內檢時,QA人員可隨時依工單、內部批號等條件,查到產品/指定批的人員、用料、設備及生產的歷程。如有任何問題,不待客戶及三方單位查驗時手忙腳亂,即可提前讓主管們作因應討論。而且透過系統的協助,在面對外部查驗時,能節省報告彙整的處理時間,減少人工彙整的處理錯誤,提供DHR報告時能更快、更準、更專業。
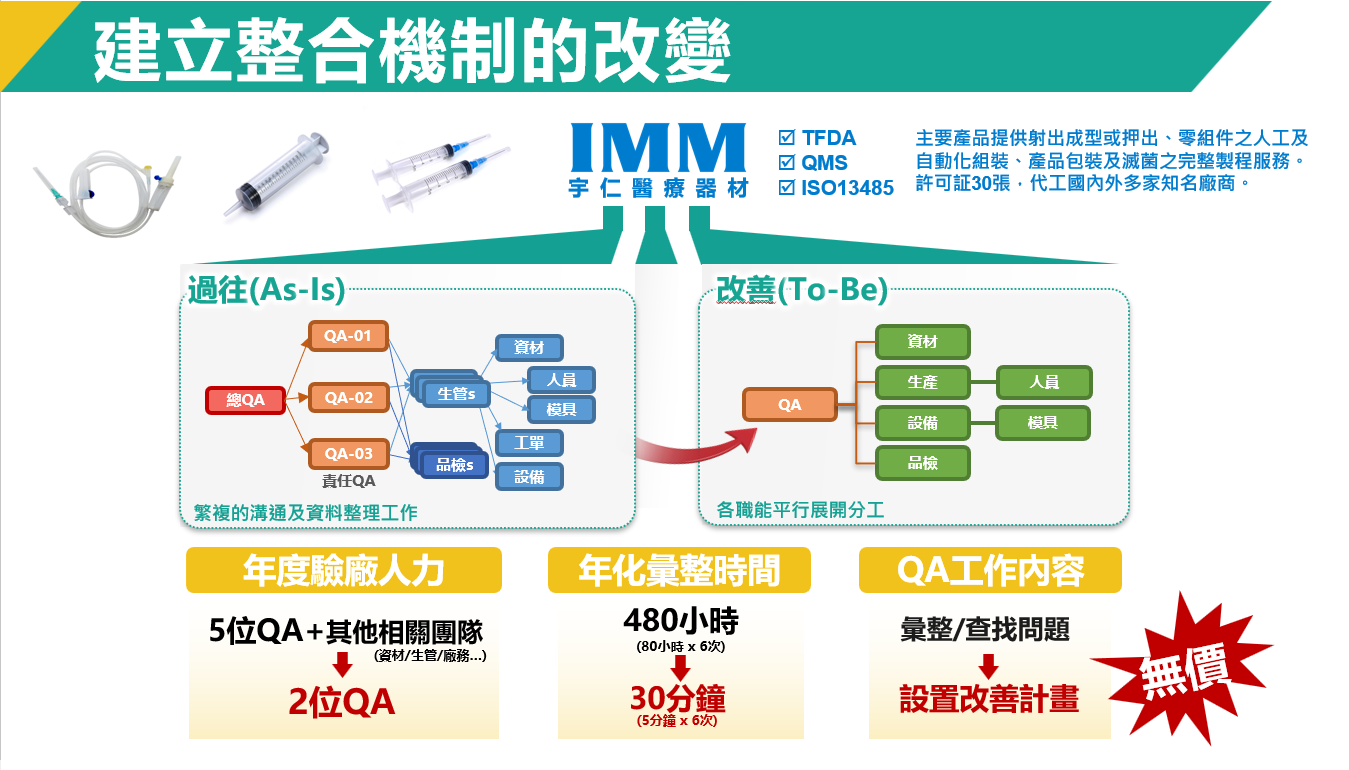
那在提前準備DHR資料這方面,要提前做哪些準備或者要提前設定那些機制呢?
之後的五集,我們就會來細談DHR的細部重點,會為大家做更詳細的說明~下一集要講的是材料認證,除了玩RPG的品保、品管以外,也歡迎倉儲、資材、物控的朋友們一起來了解喔!
生技醫點通
609 Followers
延伸閱讀
1則留言
薛xx
2025/09/07
ok
0
0
回覆
生技醫點通
609 Followers
我們使用本身的Cookie和第三方的Cookie進行分析,並根據您的瀏覽習慣和個人資料向您展示與您的偏好相關的廣告。如欲瞭解更多資訊,您可以查閱我們的隱私權政策。